争议:亚甲蓝治疗感染性休克的利弊
2024年04月25日 阅读:145次
Arias‑Ortiz and Vincent Critical Care (2024) 28:46
感染性休克通常需要使用血管加压药。肾上腺素能药物仍然是首选(去甲肾上腺素)。然而,肾上腺素能的使用有潜在的不良反应,因此,非肾上腺素能性血管加压药也不失为一种选择。一氧化氮(NO)是导致感染性休克中血压降低、血管舒张的主要驱动力。使用非选择性NO合成酶抑制剂的益处一直存在疑问。可溶性鸟苷酸环化酶抑制剂亚(参与血管平滑肌细胞NO信号通路的重要酶)亚甲蓝,也可以用于感染性休克。然而,自从第一次在脓毒性休克中使用以来,目前已过了25年了,其安全性和益处仍未完全确定。在进一步证明其有效性之前,不应在临床实践中常规使用。
脓毒症是一种常见病,每年影响全球数百万人。脓毒性休克死亡率可达35%-50%。感染性休克通常需要血管加压剂以避免严重的低血压。在目前的临床实践中,肾上腺素能药物被用作一线血管加压药物,其可通过α-1肾上腺素能受体迅速增加血管张力、提高血压。此外,它们的半衰期很短,有利于剂量滴定。然而,儿茶酚胺有潜在的副作用。肾上腺素能药物可诱导心肌缺血,减少局部血流; 还具有代谢作用(引起高血糖、细胞代谢增加、高乳酸血症),同时还具有免疫调节作用。去甲肾上腺素是首选的血管加压剂,其具有强大的α-1 肾上腺素受体刺激和适度的β-1肾上腺素能作用,这有助于维持心输出量。然而,血管过度收缩可能增加心室后负荷,从而损害左右心室功能,干扰局部血流分布,改变微循环。
考虑到肾上腺素能药物的不良后果和其他分子的可能优势,涌现出了去茶酚胺、儿茶酚胺节约和多模式血管加压药物策略,推崇非肾上腺素能血管加压药物在脓毒性休克治疗中的地位。一氧化氮(NO)抑制剂、抗利尿激素及其类似物、大剂量静脉注射羟钴胺素、血管紧张素II是当下的主要的非肾上腺素能药物。NO在脓毒症中的的作用复杂,在这篇综述中,我们将重点讨论NO抑制剂的优缺点,特别是亚甲基蓝(MB)。
在感染性休克中,鉴于对内毒素和促炎因子的反应,诱导型NO合成酶(iNOS)显著激活。一氧化氮是血管舒张的主要驱动因素,导致低血压和血管收缩剂的无反应。NO调节白细胞活性,对大多数细菌也有毒性。iNOS是脓毒症中NO生成的主要来源。在细胞水平上,NO也一种自由基,与其他自由基相互作用形成次级代谢物,如过氧亚硝酸盐(ONOO−),并通过类似的反应可以抑制脂质氧化产物并作为抗氧化剂;这种自由基清除作用减少了组织损伤。在线粒体水平,NO参与几个重要过程,包括线粒体电子传递链的调节。
已经测试了几种药物作为NOS抑制剂,这是基于如下假设:阻断或调节过度的iNOS活性在这种情况下是有益的。NOS抑制剂可以逆转NO过量产生对血管张力的负面病理生理影响,以及脓毒症期间对血管加压药物的低反应性。在临床试验中,用于脓毒症的主要药物是 非选择性NOS抑制剂,如甲基精氨酸 (L-NMMA)和硝基精氨酸(L-NNA)。这些药物已被证明可以增加全身血管阻力和平均动脉压(MAP)。然而,重要的是要记住,在感染性休克中阻断NO通路,不仅仅是对大血管血流动力学、心肌功能、肾上腺素能药物的低反应性带来影响。NO在脓毒症中的作用对于正常微血管和对感染的免疫反应至关重要;因此,感染性休克中,NO的整体抑制可能是有害的。它的多重作用可能解释为什么非选择性NO抑制剂对某些大循环变量的预期改善(例如MAP、SVR的增加)不能直接转化为进一步的临床益处,而且可能是有害的。事实上,Lopez等人进行的一项多中心、随机、安慰剂对照试验表明,在感染性休克患者中使用L-NMMA,使28天死亡率从49%增加到59%。
MB的特征略有不同,因为它是可溶性鸟苷酸环化酶(sGC)的抑制剂 ,其激活在NO信号通路中很重要。sGC在NO作用下催化cGMP的产生,cGMP可使血管松弛,抑制血管平滑肌细胞的增殖。因此,用MB阻断sGC可以抵消NO的血流动力学效应。与非选择性NOS抑制剂相比,MB可能因此阻断NO的一些有害作用,同时潜在地保持其有益作用。因此,建议在感染性休克、以及其他形式的血管截瘫性休克(主要是心脏手术、过敏性休克)或肝移植后再灌注综合征中使用MB。
MB是一种不昂贵且广泛使用的药物,最常用于治疗中毒情况下严重的高铁血红蛋白血症。当静脉给药时,MB的起效时间为30-60分钟,终末血浆半衰期为5-6小时。它由肝脏代谢,主要由肾脏排泄,因此,这些器官功能障碍的患者通过细胞色素P450抑制,毒性和药物相互作用的风险更高。MB一般耐受性良好,毒性与剂量有关;尿液、皮肤和分泌物的蓝绿色变色常见,这会干扰脉氧的准确性。更严重的不良反应,如肠系膜血管收缩和反常的高铁血红蛋白血症,已报告较高剂量至4 mg/kg。怀孕和葡萄糖-6-磷酸脱氢酶缺乏症患者中禁止使用MB。
迄今为止,大多数关于MB在感染性休克中的应用的研究都是观察性的,样本量小,异质性高,方法学质量差,无法得出高质量结论。25年前,Preiser等人报道了14例脓毒性休克患者的MB血流动力学影响。作者观察到 MAP增加,而心肌功能保存完好。其他一些学者发现,MB增加MAP,没有出现SV的下降,并且是血管加压药物需求的减少。然而,在L-NMMA试验结果于2004年发表后,使用NO抑制剂治疗感染性休克的热情迅速下降。然而,考虑到先前讨论的与肾上腺素能性血管加压药物相关的问题,MB在这些患者中的潜在作用重新引起了人们的兴趣。
在最近的一项回顾性队列研究中,对209例不同类型休克(感染性休克、心源性休克、血管麻痹性休克) 患者进行了不同给药策略(负荷量、负荷量+持续输注、持续输注)的影响,这些患者接受的去甲肾上腺素剂量> 0.1 mcg/ kg/min,乳酸浓度> 2 mmol/L。接受负荷量+持续输注策略的组生存率提高。在最近的一项随机、对照和 双盲试验中,Ibarra-Estrada等人评估了早期辅助给与MB是否可减少血管加压药物的使用时间,在此研究中,患者在接受去甲肾上腺素的前24小时内,接受静脉(IV)输注正常生理盐水或MB,每天一次,共3次,最终发现,接受MB治疗的患者停药时间较短、28天无血管加压剂天数多、ICU住院时间比 对照组短、住院时间短2.7天。然而,这项研究有一些局限性,包括尿液的相关绿色变色使研究无法双盲。如果能得到更多关于心脏功能的信息,以及关于患者减少暴露于高剂量去甲肾上腺素的时间的潜在益处,这一研究将更有说服力。
一些关于MB 休克研究的系统综述或荟萃分析也已发表,但都是基于非常有限的数据。在2010年发表的系统文献综述中,包括11项研究(8项观察性研究),其中MB用于治疗脓毒性休克 ,作者得出结论,MB与血液动力学参数的短期改善有关,但对临床结果的益处很少或没有。他们强调,在所有的研究中,MB都是在疾病的晚期给药,在不同的研究中,剂量范围(1-4 mg/kg)和给药策略都有所不同。在2022年发表的一项针对血管扩张性休克患者的15项研究的荟萃分析中,使用MB与死亡率降低相关, 但该研究汇集了观察性和随机对照研究,患者病因不同(手术、感染性休克)。在一项针对围手术期或危重患者的11项随机对照试验的荟萃分析中,Pruna等认为, MB可能与血液动力学改善、减少ICU和住院时间以及降低死亡率相关;而在一项对6项随机对照试验的荟萃分析中,Huang等人报告了MB治疗感染性休克患者,其机械通气时间和住院时间的减少,但对死亡率没有影响。这些荟萃分析纳入的研究规模小,异质性大,说服力有限。
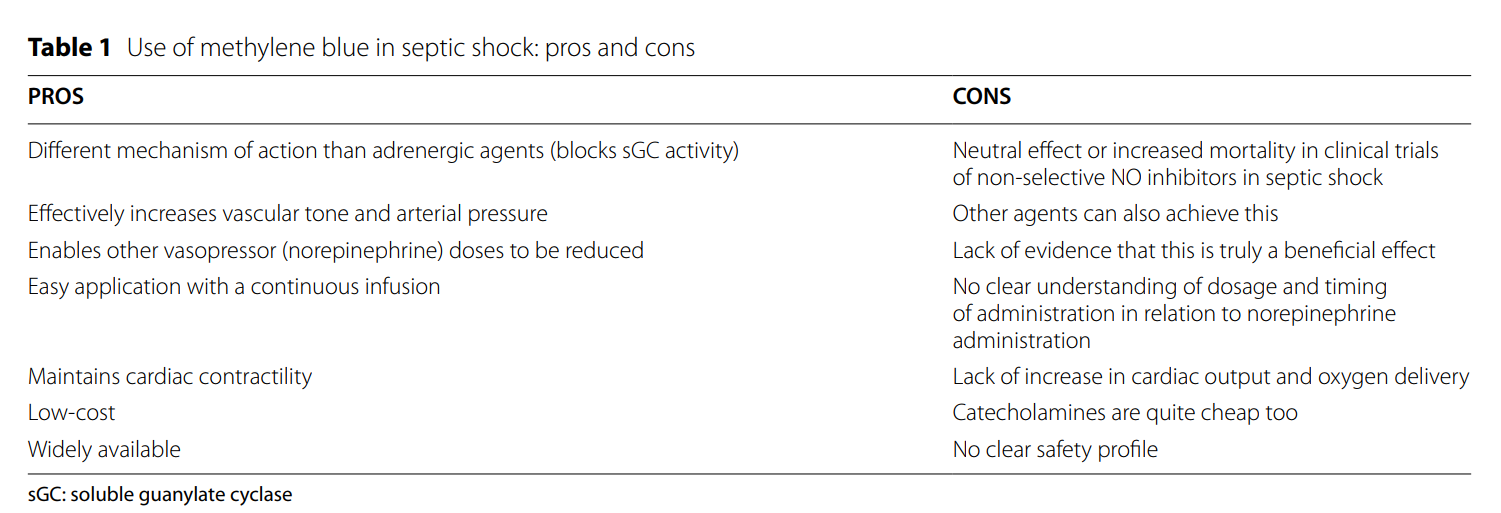
在感染性休克中使用作用于NO 通路的药物的潜在益处尚不清楚。虽然大多数证据来自小型研究,但在感染性休克中使用非选择性NO抑制剂(例如 L-NMMA和L-NNA)并没有显示为感染性休克患者提供任何实质性的益处,并且使用iNOS抑制剂会增加死亡率。MB能够增加血管张力和MAP,似乎能够维持心脏收缩力,但没有证据表明细胞氧可用性增加。除了使用MB可以持续降低血管加压素的需求外,尚未证明有显著的临床相关益处。减少肾上腺素能药物的剂量可能是有益的,但是这仍然是假设的,没有包括在大多数研究中。为了阐明感染性休克患者使用MB的最佳时机、剂量和给药策略,并最终阐明使用 MB是否真的具有有益或有害,应进行大型多中心随机对照试验。尽管在最近的研究中有一些积极的发现,但鉴于样本量小和异质性,现有的数据存在显著的局限性,在常规使用MB治疗感染性休克之前,仍需要一些证据,证明其有利的临床益处。
仅供参考,欢迎阅读原文
来源:慢慢学重症
![]()
![]()